LAPORAN PRAKTIKUM FISIOLOGI HEWAN AIR Perhitungan Sel Darah Merah dan Sel Darah Putih Pada Ikan Lele (Clarias sp.) Diajukan untuk memenuhi salah satu tugas pada Praktikum Fisiologi Hewan Air Disusun oleh : Kelompok 8 / Kelas A Nika Sembada (230110110018) Yohan Setiawan (230210110027) Pefi Firman Nurlailudin (230110110030) UNIVERSITAS PADJADJARAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN JATINANGOR 2012

Welcome message from author
This document is posted to help you gain knowledge. Please leave a comment to let me know what you think about it! Share it to your friends and learn new things together.
Transcript

LAPORAN PRAKTIKUM FISIOLOGI HEWAN AIR
Perhitungan Sel Darah Merah dan Sel Darah Putih
Pada Ikan Lele (Clarias sp.)
Diajukan untuk memenuhi salah satu tugas pada Praktikum Fisiologi Hewan Air
Disusun oleh :
Kelompok 8 / Kelas A
Nika Sembada (230110110018)
Yohan Setiawan (230210110027)
Pefi Firman Nurlailudin (230110110030)
UNIVERSITAS PADJADJARAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
JATINANGOR
2012

i
KATA PENGANTAR
Puji dan syukur penyusun panjatkan kepada Allah SWT yang telah
memberikan rahmat dan karunia-Nya sehingga penyusun dapat menyelesaikan
laporan praktikum ini. Laporan praktikum ini berjudul “Perhitungan Sel Darah
Merah dan Sel Darah Putih Pada Ikan Lele (Clarias sp.)”. Laporan praktikum ini
diajukan untuk memenuhi salah satu tugas pada Praktikum Fisiologi Hewan Air.
Penyusunan laporan praktikum ini tidak terlepas dari bantuan berbagai
pihak, untuk itu pada kesempatan ini penyusun ingin mengucapkan terima kasih
yang sebesar besarnya kepada seluruh pihak yang telah membantu dalam proses
praktikum maupun dalam penyusunan laporan ini.
Akhir kata semoga apa yang telah dilaksanakan oleh penyusun dapat
memberikan manfaat khususnya bagi pengembangan pengetahuan di bidang
perikanan dan umumnya bagi semua pihak.
Jatinangor, Desember 2012
Penyusun

ii
DAFTAR ISI
Bab Halaman
DAFTAR TABEL .................................................................................. iv
DAFTAR GAMBAR .............................................................................. v
DAFTAR LAMPIRAN .......................................................................... vi
I. PENDAHULUAN
1.1 Latar Belakang .................................................................................. 1
1.2 Tujuan Praktikum .............................................................................. 2
1.3 Manfaat Praktikum ............................................................................ 2
II. TINJAUAN PUSTAKA
2.1 Ikan Lele (Clarias sp.) ....................................................................... 3
2.2 Klasifikasi Lele (Clarias sp.) ............................................................. 4
2.3 Morfologi Lele (Clarias sp.) .............................................................. 5
2.4 Biologi Ikan Lele (Clarias sp.) .......................................................... 6
2.5 Darah Ikan .......................................................................................... 13
2.6 Sistem Peredaran Darah pada Ikan .................................................... 14
2.7 Sel Darah Merah (Eritrosit) ............................................................... 15
2.8 Nilai Hematokrit ................................................................................ 15
2.9 Sel Darah Putih (Leukosit) ................................................................. 16
2.10 Penghitungan Jumlah Eritrosit (Svobodova et al., 1991) ……… 17
2.11 Penghitungan Total Leukosit (Svobodova et al., 1991) ………. 18
2.12 Larutan Hayem’s ……………………………………….………. . 18
2.13 Larutan Turks ………………………………………………..…… 18
2.14 Haemacytometer …………………………………………..…….. 19

iii
III. METODOLOGI PRAKTIKUM
3.1 Waktu dan Tempat ............................................................................ 22
3.2 Alat dan Bahan Praktikum I............................................................... 22
3.2.1 Alat Praktikum I ............................................................................. 22
3.2.2 Bahan Praktikum I .......................................................................... 22
3.3 Prosedur Kerja Praktikum I ............................................................... 23
3.4 Alat dan Bahan Praktikum II ............................................................. 24
3.4.1 Alat Praktikum II ............................................................................ 24
3.4.2 Bahan Praktikum II ........................................................................ 24
3.4.3 Prosedur Kerja Praktikum II .......................................................... 24
IV. HASIL DAN PEMBAHASAN
4.1 Hasil Praktikum I .............................................................................. 26
4.2 Pembahasan Praktikum I ................................................................... 27
4.3 Hasil Praktikum II ............................................................................. 29
4.4 Pembahasan Praktikum II ................................................................ 31
V. KESIMPULAN DAN SARAN
5.1 Kesimpulan ....................................................................................... 34
5.2 Saran .................................................................................................. 35
DAFTAR PUSTAKA ............................................................................ 36
LAMPIRAN ........................................................................................... 39

iv
DAFTAR TABEL
Nomor Judul Halaman
1. Hasil Pengamatan Kelompok 8 Perhitungan Sel darah Merah
Pada Ikan Lele (Clarias sp.). ............................................................. 26
2. Data Kelas Hasil Pengamatan Perhitungan Sel darah Merah
Pada Ikan Lele (Clarias sp.). Laboratorium 1 ................................... 26
3. Data Kelas Hasil Pengamatan Perhitungan Sel darah Merah
Pada Ikan Lele (Clarias sp.). Laboratorium 2 ................................... 27
4. Data Kelas Hasil Pengamatan Perhitungan Sel darah Merah
Pada Ikan Lele (Clarias sp.). Laboratorium 3 ................................... 27
5. Hasil Pengamatan Kelompok 8 Perhitungan Sel darah Putih
Pada Ikan Lele (Clarias sp.). ............................................................. 29
6. Data Kelas Hasil Pengamatan Perhitungan Sel darah Putih
Pada Ikan Lele (Clarias sp.). Laboratorium 1 ................................... 29
7. Data Kelas Hasil Pengamatan Perhitungan Sel darah Putih
Pada Ikan Lele (Clarias sp.). Laboratorium 2 ................................... 30
8. Data Kelas Hasil Pengamatan Perhitungan Sel darah Putih
Pada Ikan Lele (Clarias sp.). Laboratorium 3 ................................... 30

v
DAFTAR GAMBAR
Nomor Judul Halaman
1. Ikan Lele (Clarias sp.) ......................................................................... 4
2. Sistem Peredaran Vena pada Ikan Teleostei......................................... 14
3. Sel darah Ikan Lele (Clarias ssp), Eritrosit (E), Limfosit (L),
Monosit (M), Heterofil (N), dan Trombosit (T) (Abdullah 2008) . ...... 17
4. Bagian-bagian Haemocytometer........................................................... 19
5. Haemocytometer Improved Neubaeur .................................................. 20
6. Counting Chamber................................................................................ 20
7. Kotak untuk menghitung sel darah merah . .......................................... 28
8. Kotak untuk menghitung sel darah putih .............................................. 31

vi
DAFTAR LAMPIRAN
Nomor Judul Halaman
1. Foto Alat Praktikum ............................................................................ 39
2. Foto Bahan Praktikum ......................................................................... 39
3. Foto Kegiatan Praktikum .................................................................... 40

1
BAB I
PENDAHULUAN
1.1 Latar Belakang
Dalam proses kehidupannya, organisme senantiasa berusaha
mempertahankan kelangsungan hidupnya tak terkecuali pada ikan. Salah satu
mekanisme dalam menjaga kelangsungan hidup adalah dengan melakukan proses
metabolism yang didapat dari asupan makanan. Organisme memerlukan makanan
dan oksigen untuk melakukan metabolisme di seluruh tubuhnya. Berbagai proses
metabolism menghasilkan sisa (sampah) yang harus dikeluarkan oleh tubuh.
Peredaran materi, baik berupa bahan-bahan yang diperlukan oleh tubuh seperti
oksigen maupun hasil metabolism dan sisa-sisanya dilakukan oleh system
peredaran darah.
Darah merupakan cairan terpenting dalam tubuh makhluk hidup. Darah
mengangkut oksigen, hormone, nutrien, dan hasil buangan. Darah merupakan
salah satu parameter yang dapat digunakan untuk melihat kelainan yang terjadi
pada ikan, baik yang terjadi karena penyakit ataupun karena keadaan lingkungan.
Sehingga dengan mengetahui kondisi gambaran darah kita dapat mengetahui
kondisi kesehatan suatu organisme (Delmann and Brown, 1989).
Pada ikan yang terserang penyakit terjadi perubahan pada nilai hematokrit,
kadar hemoglobin, jumlah sel darah merah dan jumlah sel darah putih.
Pemeriksaan darah (hematologis) dapat digunakan sebagai indikator tingkat
keparahan suatu penyakit (Bastiawan, dkk., 2001). Studi hematologis merupakan
kriteria penting untuk diagnosis dan penentuan kesehatan ikan (Lestari, 2001).
Oleh karena itu, penting bagi kita melakukan pengujian terhadap kualitas
darah dari suatu jenis ikan atau organisme akuatik lainnya untuk mengetahui dan
menyimpulkan kondisi dari organisme tersebut. Pengujian tersebut dapat
dilakukan dengan menghitung jumlah sel darah merah dan sel darah putih dari
suatu sampel ikan.

2
1.2 Tujuan Praktikum
Tujuan dari praktikum ini adalah menghitung jumlah sel darah merah dan
sel darah putih pada ikan lele (Clarias sp.).
1.3 Manfaat Praktikum
Manfaat dari praktikum yang kami lakukan adalah praktikan dapat
menghitung dan mengetahui jumlah sel darah merah dan sel darah putih pada ikan
lele (Clarias sp). Praktikan juga dapat mengetahui dan menyimpulkan kondisi
ikan dari hasil perhitungan jumlah sel darah merah dan sel darah putih ini.

3
BAB II
TINJAUAN PUSTAKA
2.1 Ikan Lele (Clarias sp.)
Ikan lele (Clarias sp.) menurut Suyanto (2007) termasuk ke dalam filum
Chordata, kelas Pisces, sub-kelas Teleostel, ordo Ostariophysi, sub-ordo
Siluroidea, famili Clariidae, genus Clarias sp.
Jenis ikan lele yang paling banyak dijumpai dan dibudidayakan di
Indonesia adalah Clarias batrachus (lele lokal) dan Clarias gariepinus (lele
dumbo). Namun demikian, sifat dan pertumbuhan kedua jenis ikan lele ini
berbeda. Warna badan ikan lele dumbo (Clarias gariepinus) akan berubah
menjadi loreng - loreng apabila terkejut atau menderita stress, gerakan tubuh lebih
agresif, patil tidak beracun, tidak merusak pematang. Warna badan ikan lele lokal
(Clarias batrachus) akan berubah menjadi gelap apabila terkejut atau menderita
stress, gerakan tubuh tidak agresif, patil beracun, dan merusak pematang dengan
membuat lubang. Bobot badan ikan lele dumbo (Clarias gariepinus) mencapai 10
- 15 gram/ekor dalam waktu 5 minggu, sedangkan bobot badan ikan lele lokal
(Clarias batrachus) hanya mencapai 1 – 1,5 gram/ekor dalam waktu yang sama
(Suyanto 2007).
Ikan lele (Clarias sp.) memiliki kemampuan hidup di dalam lumpur dan
air dengan kandungan oksigen rendah. Hal ini disebabkan karena ikan ini
memiliki alat pernapasan tambahan (arborescent) yang terdapat di dalam ruang
udara sebelah atas insang, sehingga ikan lele dapat mengambil oksigen untuk
bernafas langsung dari udara di luar air (Suyanto 2007).
Ikan lele (Clarias sp.) termasuk hewan malam (nokturnal), yang aktif
bergerak pada malam hari dan bersembunyi pada siang hari. Pakan ikan lele
berupa pakan alami dan pakan tambahan (Suyanto 2007).
Ikan Lele merupakan jenis ikan konsumsi air tawar. Di Indonesia ikan lele
mempunyai beberapa nama daerah, antara lain: ikan kalang (Padang), ikan maut

4
(Gayo, Aceh), ikan pintet (Kalimantan Selatan), ikan keling (Makasar), ikan cepi
(Bugis), ikan lele atau lindi (Jawa Tengah). Sedang di negara lain dikenal dengan
nama mali (Afrika), plamond (Thailand), ikan keli (Malaysia), gura magura
(Srilangka), ca tre trang (Jepang). Dalam bahasa Inggris disebut pula catfish,
siluroid, mudfish dan walking catfish. Ikan lele tidak pernah ditemukan di air
payau atau air asin. Habitatnya di sungai dengan arus air yang perlahan, rawa,
telaga, waduk, sawah yang tergenang air.
2.2 Klasifikasi Lele (Clarias sp.)
Menurut Saanin (1984), klasifikasi dari Ikan Lele (Clarias sp.) adalah
sebagai berikut :
Kingdom : Animalia
Sub-kingdom : Metazoa
Phyllum : Chordata
Sub-phyllum : Vertebrata
Class : Pisces
Sub-class : Teleostei
Ordo : Ostariophysi
Sub-ordo : Siluroidea
Familia : Clariidae
Genus : Clarias
Spesies : Clarias sp.
Gambar 1. Ikan Lele (Clarias sp.)
(Dokumen Pribadi, 2012)

5
2.3 Morfologi Lele (Clarias sp.)
Ikan lele (Clarias sp.) mempunyai ciri – ciri yang bisa digunakan untuk
membedakan dengan jenis ikan lainnya, yaitu memiliki bentuk memanjang,
bagian badan bulat dan memipih ke arah ekor, tidak bersisik serta mengeluarkan
mukus. Ikan lele memiliki kepala berbentuk pipih dan simetris, memiliki patil,
mulut lebar, tidak bergigi, dan mulut memiliki sepasang sungut mandibular dan
sepasang sungut maksilar yang lebih panjang dan tegar, daerah kepala sampai
punggung berwarna coklat kehitaman. Ikan lele memiliki sifat tenang dan lebih
jinak (Suyanto 2007).
Badan lele berbentuk memanjang dengan kepala pipih ke bawah
(depressed). Mulut berada di ujung (terminal) dengan sepasang sungut, nasal,
rahang atas, rahang bawah, dan mental. Sirip ekor membundar tidak bergabung
dengan sirip anal. Sirip perut juga membundar. Mempunyai alat pernafasan yang
terdapat dalamrongga insang, bentuknya merupakan membran berlipat-lipat yang
penuh dengan kapiler darah dan berada dalam ruang udara sebelah atas insang.
Ikan lele memiliki patil yang digunakan untuk melompat dari kolam atau berjalan
di atas tanah. Oleh karena itu lele mempunyai predikat tambahan sebagai walking
catfish (Suyanto, 2007).
Alat pernafasan tambahan terletak di bagian kepala di dalam rongga yang
dibentuk oleh dua pelat tulang kepala. Alat pernafasan iniberwarna kemerahan
dan berbentuk seperti tajuk pohon rimbun yang penuh kapiler-kapiler darah. Alat
pernafasan tambahan tersebut sering disebut dengan nama labyrinth yang
memungkinkan lele mengambil oksigen langsung dari udara untuk pernafasan
(Hernowo, 2008). Mulutnya terdapat di bagian ujung moncong dan dihiasi oleh
empat pasang sungut, yaitu satu pasang sungut hidung, satu pasang sungut
maksilar dan dua pasang sungut mandibula. Fungsi sungut tersebut adalah sebagai
alat peraba ketika berenang dan sebagai sensor ketika mencari makan.
Najiyati (2003), menyatakan bahwa ikan lele mempunyai bentuk badan
yang memanjang, berkepala pipih, tidak bersisik, memiliki empat pasang kumis
yang memanjang sebagai alat peraba, dan memiliki alat pernafasan tambahan.

6
Bagian depannya terdapat penampang melintang yang membulat, sedang bagian
tengah dan belakang berbentuk pipih.
Sebagaimana halnya ikan dari jenis lele, lele memiliki kulit tubuh yang
licin, berlendir, dan tidak bersisik. Jika terkena sinar matahari, warna tubuh lele
berubah menjadi pucat dan jika terkejut warna tubuhnya otomatis menjadi loreng
seperti mozaik hitam-putih. Mulut lele relatif lebar, yaitu sekitar ¼ dari panjang
total tubuhnya. Tanda spesifik dari lele dumbo adalah adanya kumis di sekitar
mulut sebanyak 8 buah yang berfungsi sebagai alat peraba saat bergerak atau
mencari makan (Khairuman dan Amri, 2002).
Siripnya terdiri dari lima jenis, yaitu sirip dada, sirip punggung, sirip
perut, sirip dubur, dan sirip ekor. Sirip dadanya berbentuk bulat agak memanjang
dengan ujung runcing, dan dilengkapi dengan sepasang duri yang biasa disebut
patil. Patil pada lele sangkuriang dan lele dumbo tidak begitu kuat dan tidak
begitu beracun dibanding jenis lele lainnya (Najiyati, 2003).
2.4. Biologi Ikan Lele (Clarias sp.)
Ikan lele adalah anggota dari family Ictaluridae yang terdiri dari tujuh
marga dan paling sedikit 45 spesies. Ikan lele tersebar luas di benua Afrika dan
Asia, terdapat di perairan umum yang berair tawar secara liar. Di beberapa negara
khususnya Asia, seperti Filipina, Thailand, Indoneia, Laos, Kamboja, Vietnam,
Birma dan India, ikan lele telah banyak dibudidayakan dan dipelihara di kolam.
Di Indonesia ikan lele ini secara alami terdapat di pulau Jawa (Suyanto, 2006).
Banyak macam-macam ikan yang baik, tetapi untuk ikan lele hampir semua
produksi foodfish komersial di Amerika Serikat.
Ikan lele yang asli terdapat di pusat Amerika Utara antara pegunungan
Rocky dan Appalachian, dari Teluk Meksiko utara ke drainase Teluk Hudson.
Ikan lele adalah ikan aktif yang populer, dan telah diperkenalkan secara luas di
seluruh Amerika Utara.

7
Habitat
Habitat atau lingkungan hidup ikan lele adalah semua perairan tawar,
meliputi sungai dengan aliran yang tidak terlalu deras atau perairan yang tenang
seperti waduk, danau, telaga, rawa, dan genangan air seperti kolam. Ikan lele
tahan hidup di perairan yang mengandung sedikit oksigen dan relatif tahan
terhadap pencemaran bahan-bahan organik.
Suyanto (2006), menyatakan lele dapat hidup normal di lingkungan yang
memiliki kandungan oksigen (DO) terlarut 4 ppm dan air yang odeal bagi leel
dumbo mempunyai kadar karbondioksida kurang dari 2 ppm, namun pertumbuhan
dan perkembangan ikan lele akan cepat dan sehat jika dipelihara dari sumber air
yang cukup bersih, seperti air sungai, mata air, saluran irigasi ataupun aikr sumur.
Ikan lele dapat hidup baik di dataran rendah sampai dengan perbukitan yang tidak
terlalu tinggi, misalnya di daerah pegunungan dengan perbukitan yang tidak
terlalu tinggi, misalnya di daerah pegunungan dengan ketinggian di atas 700 m.
Di samping itu lele dumbo juga bisa hidup pada perairan yang sedikit
payau, seperti di Kendal, Jawa Tengah. Aktivitasnya pada siang hari dan lebih
menyukai tembat-tempat yang gelap, agak dalam dan teduh. Hal ini bisa
dimengerti karena lele adalah binatang nokturnal, yaitu mempunyai
kecenderungan beraktivitas dan mencari makan pada malam hari. Pada siang hari
lele lebih sukaberdiam atau berlindung di tempat-tempat yang gelap. Akan tetapi,
pada kolam pemeliharaan, terutama budidaya secara intensif, lele dapat dibiasakan
diberi pakan pellet pada pagi atau siang hari, walaupun nafsu makannya tetap
lebih tinggi jika diberikan pada malam hari.
Lele juga mampu hidup di luar air (dasar) selama beberapa jam, asalkan
udara disekitarnya cukup lembab. Semua kelebihan tersebut membuat ikan ini
tidak memerlukan kualitas air yang jernih atau mengalir ketika dipelihara di
kolam. Karena itu lele dapat juga dipelihara pada kondisi kualitas air yang buruk,
seperti comberan, atau tempat pembuangan air limbah rumah tangga yang terdapat
di belakang rumah. Walaupun begitu para ahli perikanan tetap memberi syarat
darikualitas air (kimia dan fisika) yang harus dipenuhi jika ingin sukses
membudidayakan lele. Berikut ini persyaratan yang dikemukakan oleh Khairuman

8
(2008): suhu yang cocok ontuk memelihara lele dumbo adalah 20-30 0C dan
optimal 270C, kandungan oksigen dalam air minimal 3 ppm, NH3 sebesar 0,05
ppm, NO2 sebesar 0,25 ppm, NO3 sebesar 250 ppm.
Suyanto (2006) menyatakan bahwa ikan lele digolongkan sebagai ikan
karnivora. Pakan alami yang baik untuk benih ikan lele adalah jenis zooplankton
seperti Moina sp., Daphnia sp., cacing-cacing, larva (jentik-jentik serangga),
siput-siput kecil dan sebagainya. Pakan alami biasanya digunakan untuk peberian
pakan lele pada fase larva sampai benih. Ikan lele biasanya mencari makanan di
dasar kolam.
Kebiasaan Makan
Murhananto (2002), menyatakan bahwa ikan lele dapat memakan segala
macam makanan. Pakan alami ikan lele adalah binatang-binatang renik yang
hidup di lumpur dasar maupun didalam air, antara lain cacing, jentik-jentik
nyamuk, serangga lainnya, anak-anak siput, kutu air (zooplankton). Selain itu, lele
juga dapat memakan kotoran atau bahkan apa saja yang ada dalam air. Lele
merupakan jenis ikan pemakan campuran (omnivora)tidak banyak memilih pakan
yang akan dimakannya. Ikan ini lebih mudah menyesuaikan dengan makanan
yang diberikan.
Selain pakan alami, lele juga memerlukan pakan tambahan untuk
pertumbuhan dan mempercepat kematangan gonad. Untuk itu, jenis pakan
tambahannya harus banyak mengandung protein hewani yang mudah dicerna.
pakan tambahan yang digunakan dapat berupa pellet komersial yang mengandung
protein diatas 20% (Prihartono et al., 2000).
Menurut Mahyuddin (2008), menyatakan bahwa lele mempunyai
kebiasaan makan di dasar perairan atau kolam (bottom feeder).berdasarkan jenis
pakannya, lele digolongkan sebagai ikan yang bersifat karnivora (pemakan
daging). Di habitat aslinya, lele memakan cacing, siput air, belatung, laron, jetik-
jentik serangga, kutu air dan larva serangga air. Karena bersifat karnivora, pakan
tambahan yang baik untuk lele adalah yang banyak mengandung protein hewani.

9
Jika pakan yang diberikan mengandung pritein nabati, pertumbuhannya
lambat. Lele bersifat kanibalisme, yaitu sifat yang suka memangsa jenisnya
sendiri. Jika kurang pakan, lele tidak segan-segan memangsa kawan sendiri. sifat
kanibalisme juga akan timbul oleh karena perbedaan ukuran. Lele yang berukuran
besar akan memangsa ikan lele yang berukuran lebih kecil.
Pemijahan Ikan Lele
Di alam, pemijahan ikan lele lebih banyak terjadi pada musim penghujan.
Rangsangan pemijahan berhubungan erat dengan bertambahnya volume air yang
biasa terjadi pada musim hujan dan meningkatkan kualitas air serat ketersediaan
jasad renik (pakan alami). Lele terangsang memijah setelah hujan lebat dan
munculnya bau tanah yang cukup menyengat (bau ampo) dari tanah kering kena
air hujan. Pada musim penghujan terjadi peningkatan kedalaman air yang dapat
merangsang ikan lele memijah. Ikan lele lebih suka memijah di tempat terlindung
dan teduh. Lele berkembang biak secara ovipar (eksternal), yaiti pembuahan
terjadi di luar tubuh.pada pembenihan lele lokal di kolam budidaya dapat
dilakukan denagn dua cara yaitu berpasang dan masal. Pada pembenihan secara
massal, induk jantan akan mencari sendiri pasangan induk betina, demikian juga
sebaliknya. Jika telah menemukan pasangannya, lele lokal akan tetap setia
terhadap pasangannya dalam melakukan pemijahan.
Sementara itu, pembenihan lele lokal secara berpasangan dalam satu
kolam hanya berisi satu induk jantan dan satu induk betina yang siap memijah.
Induk lele yang telah memijah, pada pagi harinya akan melihat telur-telur yang
menempel di ijuk. Kedua induk lele secara bergantian akan menjaga telur-telurnya
hingga menetas kurang lebih selama dua hari. Lele yang dibudidayakan di kolam
dapat dikawinkan sepanjang tahun asalkan dikelola dengan baik.
Suyanto (2006), menyatakan bahwa berdasarkan pengalaman para petani
umumnya ikan lele dapat dipijahkan setiap saat sepanjang tahun apabila air media
peliharaannya dilakukan pergantian secara terus menerus. Selain itu, pemijahan
juga dipengaruhi oleh pakan yang diberikan, semakin baik mutu pakan lele

10
semakin meningkat vitalitas dan kematangan gonadnya, sehingga induk lele akan
lebih sering memijah.
Ikan lele mentolerir berbagai kondisi lingkungan. Suhu air optimum untuk
pertumbuhan adalah 75- 85º F, namun ikan dapat bertahan hidup pada suhu dari
atas titik beku untuk hampir 100º F. Pertumbuhannya lambat pada suhu kurang
dari 65º F dan aktivitas makan berhenti pada suhu di bawah sekitar 50º F. Suhu air
maksimal di mana ikan lele dapat bertahan hidup tanpa batas adalah sekitar 95º F
dan ikan bertahan hidup hanya sebentar pada suhu di atas 100º F. Lele mentolerir
salinitas dari 0-11 ppt, meskipun salinitas kurang dari 4 ppt lebih disukai. Telur
mentolerir salinitas setinggi 16 ppt namun menetas hanya pada 8 ppt atau kurang.
Larva lele yang baru menetas memiliki cadangan makanan berupa kuning
telur (yolksack) yang akan diserap sebagai makanan bagi larva sehingga larva
tidak perlu diberi pakan. Penetasan telur dan penyerapan yolksack akan lebih
cepat terjadi pada suhu yang lebih tinggi. Pemeliharaan larva dilakukan pada
tahap penetasan. Pemberian pakan dapat dilakukan setelah larva berumur 4-5 hari
atau saat larva sudah dapat berenang dan berwarna hitam. Umumnya
pemeliharaan larva dilakukan 5 hari dengan menghasilkan benih berukuran 0,7-
1,0 cm dengan berat 0,002 gram (Sunarma, 2004).
Usia kedewasaan seksual bervariasi dari 2 sampai 12 tahun, tergantung
pada panjang musim pertumbuhan (umumnya ikan matang lebih cepat di iklim
hangat). Di alam, dari 2 sampai 4 tahun mungkin diperlukan untuk mencapai berat
1 pon, meskipun tingkat pertumbuhan tergantung pada suhu dan ketersediaan
pangan. Ikan lele dapat hidup lebih dari 20 tahun dan mencapai berat lebih dari 40
kilogram.
Kualitas Air
Kualitas air merupakan faktor penting dalam budidaya ikan, karena
diperlukan sebagai media hidup ikan. Beberapa peubah fisika dan kimia yang
dapat mempengaruhi hidup ikan lele (Clarias spp) adalah suhu, oksigen terlarut,
karbondioksida bebas, pH, dan amonia (Weatherley 1972).

11
Suhu
Ikan lele mudah beradaptasi dengan lingkungan yang tergenang air.
Apabila sudah dewasa dapat diadaptasikan di dalam lingkungan perairan yang
mengalir (Puspowardoyo dan Djarijah 2002). Suhu merupakan faktor yang
mempengaruhi laju metabolisme dan kelarutan gas dalam air. Suhu yang ideal
untuk pemeliharaan ikan lele berkisar antara 250
C - 300
C, dimana di atas suhu
tersebut nafsu makan lele akan berkurang. Selain itu, tingginya temperatur air
akan menyebabkan peningkatan aktivitas metabolisme organisme yang ada.
Tingginya aktifitas metabolisme menyebabkan kandungan gas terlarut akan
berkurang. Rendahnya kandungan gas terlarut dalam kurun waktu yang lama akan
menyebabkan ikan lele lemas, bahkan mati. Perlu adanya pengaturan tingkat
kepadatan ikan lele, khususnya benih ikan lele dalam wadah pemeliharaan, agar
sesuai dengan laju metabolisme kompenen perairan yang terjadi (Zonneveld et al.,
1991).
Oksigen Terlarut
Oksigen sangat diperlukan ikan lele untuk keperluan pernapasan dan
metabolisme. Perbedaan struktur molekul darah antar jenis ikan mempengaruhi
hubungan antara tekanan parsial oksigen dalam air dan derajat kejenuhan oksigen
dalam darah. Oksigen diperlukan ikan untuk katabolisme yang menghasilkan
energi bagi aktivitas seperti berenang, reproduksi, dan pertumbuhan. Kebutuhan
oksigen bagi ikan berbeda – beda tergantung spesies (Irianto 2005). Umumnya
ikan lele mampu hidup normal pada kandungan oksigen terlarut sebesar 4 mg per
liter. Jika persediaan oksigen di bawah 20% dari kebutuhan normal, ikan lele akan
lemas dan menyebabkan kematian (Murhananto 2002).
Karbondioksida
Kandungan karbondioksida yang ideal untuk ikan lele berkisar antara 0 –
12,8 mg/liter (Murhananto 2002). Jumlah kandungan karbondioksida dalam suatu
lingkungan perairan ditentukan oleh bahan organik dan binatang air yang
terkandung di dalamnya. Semakin banyak bahan organik yang mengurai, kadar

12
karbondioksida akan semakin tinggi. Demikian pula dengan metabolisme yang
ada, berbanding lurus dengan kadar karbondioksida (Boyd 1990). Proses
keracunan terhadap ikan terjadi karena karbondioksida mudah terikat oleh
hemoglobin, sehingga konsentrasi hemoglobin berkurang dan dalam keadaan
demikian dapat menyebabkan ikan mati lemas. Adanya alat pernapasan tambahan
(arborescent) pada ikan lele dapat membantu ikan dalam mengambil oksigen
langsung dari udara di luar air untuk kebutuhan pernapasannya (Sumpeno 2005).
Amonia
Amonia merupakan produk akhir katabolisme protein yang dieksresikan
ke luar tubuh ikan melalui insang dan kulit. Amonia ikut berperan dalam regulasi
ion melalui pertukaran dengan ion Na+
. Konsentrasi amonia di dalam lingkungan
perairan kolam budidaya ditentukan oleh beberapa faktor, yaitu seberapa baik
kolam budidaya dikelola dan lama waktu ikan dipuasakan sebelum penanganan.
Boyd (1990) melaporkan bahwa amonia berpengaruh terhadap pertumbuhan ikan,
yaitu penggunaan energi yang lebih akibat stres yang ditimbulkan. Menurut
Khairuman dan Amri (2002), kandungan maksimum amonia di dalam suatu
wadah pemeliharaan untuk benih ikan lele yang masih dapat ditolerir adalah
1mg/liter (Khairuman dan Amri 2002).
pH
Irianto (2005) melaporkan bahwa ikan dapat hidup pada pH yang berkisar
antara 5,0 – 9,5. Namun demikian, pada umumnya pH yang diperlukan untuk
budidaya perikanan berkisar antara 6,7 – 8,3. pH yang baik untuk pertumbuhan
ikan lele berkisar antara 6,5 – 9,0. pH kurang dari 5 sangat buruk bagi kehidupan
ikan lele karena dapat menyebabkan terjadinya penggumpalan lendir di dalam
insang dan dapat menyebabkan kematian, sedangkan pH di atas 9 kurang baik
bagi perkembangan ikan lele, karena dapat menghambat pertumbuhan dan
menurunkan nafsu makan (Murhanto 2002). Tinggi rendahnya pH dalam suatu
perairan dipengaruhi oleh banyaknya kotoran di dalam lingkungan perairan yang
berasal dari sisa pakan dan hasil metabolisme (Sumpeno 2005).

13
2.5 Darah Ikan
Darah ikan mengalir dari jantung melalui aorta ventral dan arteri – arteri
brankhial menuju ke insang untuk keperluan oksigenasi (Irianto 2005). Darah ikan
tersusun dari sel – sel darah yang tersuspensi dalam plasma yang diedarkan ke
seluruh jaringan tubuh (Moyle dan Cech 1988). Fungsi darah ikan antara lain
mengedarkan sari makanan dan oksigen ke seluruh tubuh (Lagler et al. 1977).
Darah ikan terdiri dari atas komponen cairan (plasma) dan komponen
seluler (sel-sel darah). Sel-sel darah terdiri dari eritrosit (sel darah merah), leukosit
(sel darah putih) dan trombosit (keping darah), yang diedarkan ke seluruh tubuh
melalui sistem sirkulasi tertutup (Wedemeyer et al., 1990). Sel dan plasma darah
mempunyai peranan fisiologis yang sangat penting. Plasma darah adalah suatu
cairan jernih yang mengandung mineral terlarut, hasil absorpsi dari pencernaan
makanan, buangan hasil metabolisme, serta gas terlarut (Lagler et al., 1977).
Leukosit dikelompokkan ke dalam granulosit dan agranulosit berdasarkan
ada tidaknya butir – butir (granul) di dalam sitoplasma. Termasuk ke dalam
kelompok granulosit yaitu heterofil, eosinofil dan basofil. Jenis leukosit ini
memiliki sifat reaksi terhadap zat tertentu yaitu eosinofil yang bersifat asidofil
(berwarna merah oleh eosin), basofil berwarna basofil (ungu), dan heterofil
bersifat tidak basofil maupun asidofil (Dellman dan Brown 1989). Agranulosit
dibagi menjadi monosit dan limfosit (Lagler et al., 1977). Agranulosit tidak
memiliki butir sitoplasmik spesifik dan ditandai dengan inti berbentuk lonjong,
bulat dengan lekuk yang khas (Dellman dan Brown 1992).
Chinabut et al. (1991) melaporkan bahwa trombosit pada ikan berbentuk
bulat memanjang atau lonjong dan berperan dalam proses pembekuan darah
karena ikut serta dalam mengaktifkan protrombin menjadi trombin. Ciri khusus
trombosit adalah adanya lingkaran sitoplasma tipis di sekeliling inti yang akan
berwarna ungu tua saat diwarnai dengan Giemsa. Ukuran rata – rata trombosit
berkisar antara (4 x 7 μm) – (5 x 13 μm).
Wedemeyer et al. (1990) melaporkan bahwa pemeriksaan darah penting
untuk membantu peneguhan diagnosa suatu penyakit. Penyimpangan fisiologis
ikan akan menyebabkan terjadinya perubahan pada gambaran darah, baik secara

14
kualitatif maupun kuantitatif. Darah akan mengalami perubahan yang serius
khususnya apabila terkena penyakit infeksi (Amlacher 1970). Parameter darah
yang dapat memperlihatkan adanya gangguan adalah nilai hematokrit, konsentrasi
hemoglobin, jumlah eritrosit (sel darah merah) dan jumlah leukosit (sel darah
putih) (Lagler et al., 1977).
2.6 Sistem Peredaran Darah pada Ikan
Seperti pada golongan vertebrata lainnya, ikan mempunyai sistem
peredaran darah tertutup, artinya darah tidak pernah keluar dari pembulunya, jadi
tidak ada hubungan langsung dengan sel tubuh sekitarnya. Darah memberi bahan
materi dengan perantaraan difusi melalui dinding yang tipis dari kapiler darah,
dan kembali ke jantung melalui pembulu yang ke dua. Seri pertama dinamakan
sistem arteri dan seri ke dua disebut sistem vena.
Sistem peredaran darah, organ utamanya adalah jantung yang bertindak
sebagai pompa tekan merangkap pompa hisap. Darah ditekan mengalir keluar dari
jantung melalui pembuluh arteri ke seluruh tubuh sampai ke kapiler darah,
kemudian dihisap melalui pembuluh vena dan kembali ke jantung. Sistem
peredaran darah ini disebut sistem peredaran darah tunggal.
Peredaran darah mempunyai peranan penting terutama dalam
pengangkutan oksige hasil respirasi, pengangkutan nutrien hasil proses
pencernaan, dan pengangkutan sisa metabolisme yang selanjutnya dibuang
melalui insang, kulit dan ginjal. Oleh karena itu sistem sirkulasi erat kaitannya
dengan proses pernapasan, sekresi, pencernaan dan osmoregulasi.
Gambar 2. Sistem Peredaran Vena pada Ikan Teleostei

15
2.7 Sel Darah Merah (Eritrosit)
Eritrosit pada ikan merupakan jenis sel darah yang paling banyak
jumlahnya. Bentuk eritrosit pada semua jenis ikan hampir sama. Eritrosit pada
ikan memiliki inti, seperti pada bangsa burung dan reptil. Jumlah eritrosit pada
ikan teleostei berkisar antara (1,05 - 3,0) x 106
sel/mm3
(Irianto 2005). Eritrosit
berwarna kekuningan, berbentuk lonjong, kecil, dengan ukuran berkisar antara 7 -
36 μm (Lagler et al. 1977). Eritrosit yang sudah matang berbentuk oval sampai
bundar, inti berukuran kecil dengan sitoplasma besar. Ukuran eritrosit ikan lele
(Clarias ssp) berkisar antara (10 x 11 μm) – (12 x 13 μm), dengan diameter inti
berkisar antara 4 – 5 μm. Jumlah eritrosit ikan lele (Clarias ssp) adalah 3,18 x 106
sel/ml (Angka et al., 1985). Jika diwarnai dengan pewarnaan Giemsa, inti sel akan
berwarna ungu dan dikelilingi oleh plasma berwarna biru muda (Chinabut et al.
1991). Rendahnya eritrosit merupakan indikator terjadinya anemia, sedangkan
tingginya jumlah eritrosit menandakan ikan dalam keadaan stres (Wedemeyer dan
Yasutake 1977).
2.8 Nilai Hematokrit
Hematokrit adalah persentase eritrosit di dalam darah (Guyton 1997).
Hematokrit digunakan untuk mengukur perbandingan antara eritrosit dengan
plasma, sehingga hematokrit memberikan rasio total eritrosit dengan total volume
darah dalam tubuh. Nilai hematokrit dipengaruhi oleh ukuran dan jumlah eritrosit
(Ganong 1995). Nilai hematokrit pada ikan teleostei berkisar antara 20 - 30% dan
pada ikan laut bernilai sekitar 42% (Bond 1979). Presentase nilai hematokrit ikan
lele (Clarias spp) normal berkisar antara 30,8 - 45,5% (Angka et al., 1985). Nilai
hematokrit secara langsung berhubungan dengan jumlah eritrosit dan konsentrasi
hemoglobin (Swenson 1977). Nilai hematokrit di bawah 30% menunjukan adanya
defisiensi eritrosit (Nabib dan Pasaribu 1989). Amlacher (1970) melaporkan
bahwa selain infeksi bakteri, nafsu makan juga berpengaruh pada jumlah eritrosit
sehingga berpengaruh pula terhadap nilai hematokrit dan konsentrasi hemoglobin
di dalam sirkulasi darah.

16
2.9 Sel Darah Putih (Leukosit)
Leukosit merupakan jenis sel yang aktif di dalam sistem pertahanan tubuh.
Setelah dihasilkan di organ timus dan ginjal, leukosit kemudian diangkut dalam
darah menuju ke seluruh tubuh (Irianto 2005). Leukosit akan ditanspor secara
khusus ke daerah yang mengalami peradangan yang serius (Guyton 1997).
Leukosit tidak berwarna dan jumlah leukosit total ikan teleostei berkisar
antara 20.000-150.000 butir tiap mm3
. Leukosit berbentuk lonjong sampai bulat
(Moyle dan Chech 1988). Pada ikan lele, mas, dan nila, leukosit jenis eosinofil
dan basofil jarang ditemukan, kecuali bila ada reaksi kekebalan dengan
perantaraan sel (Nabib dan pasaribu 1989).
Limfosit, dengan pewarnaan Giemsa, berbentuk bundar dengan sejumlah
kecil sitoplasma non granula berwarna biru cerah atau ungu pucat (Chinabut et al.
1991). Limfosit bersifat aktif dan mempunyai kemampuan berubah bentuk dan
ukuran. Limfosit mampu menerobos jaringan atau organ tubuh yang lunak untuk
pertahanan tubuh (Dellman dan Brown 1992). Ukuran rata – rata limfosit berkisar
antara 4,5 - 12 μm (Moyle dan Chech 1988). Persentase normal limfosit pada ikan
teleostei berkisar antara 71,12 – 82,88% (Affandi dan Tang 2002). Jumlah
limfosit di dalam darah ikan lebih banyak dibandingkan dengan limfosit pada
mamalia. Kepadatan limfosit pada ikan sebesar 48 x 103
sel/mm3,
sedangkan pada
mamalia sekitar 2 x 103
sel/mm3
(Roberts 1978).
Monosit berbentuk oval atau bundar, dengan diameter berkisar antara 6 -
15 mikron, memiliki inti berbentuk oval. Inti terletak berdekatan dengan tepi sel
dan mengisi sebagian isi sel. Persentase monosit pada ikan teleostei sekitar 0,1%
dari seluruh populasi leukosit yang bersirkulasi. Monosit pada ikan memiliki
morfologi yang hampir sama dengan monosit pada mamalia (Roberts 1978).
Nabib dan Pasaribu (1989) melaporkan bahwa monosit bersama makrofag akan
memfagositosis sisa – sisa jaringan dan agen penyebab penyakit.

17
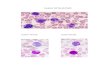
Gambar 3. Sel darah Ikan Lele (Clarias ssp), Eritrosit (E), Limfosit (L),
Monosit (M), Heterofil (N), dan Trombosit (T) (Abdullah 2008).
Heterofil berbentuk bulat dan berukuran besar, diameter berkisar antara 9 -
13 mikron, memiliki sitoplasma dalam jumlah besar dan bergranul. Sitoplasma
berwarna biru cerah atau ungu pucat, sedangkan inti berwarna biru gelap
(Chinabut et al. 1991). Jumlah heterofil di dalam darah akan meningkat apabila
terdapat infeksi oleh bakteri (Dellman dan Brown 1992). Roberts (1978)
melaporkan bahwa persentase heterofil pada ikan berkisar antara 6 - 8%. Jumlah
heterofil pada ikan teleostei hampir sama dengan jumlah neutrofil pada mamalia,
yaitu berkisar antara (3 – 6) x 103
sel/mm3
.
2.10 Penghitungan Jumlah Eritrosit (Svobodova et al., 1991)
Penghitungan jumlah eritrosit yaitu darah sampel dihisap dengan pipet
yang berisi bulir pengaduk warna merah sampai skala 0,5, selanjutnya ditambah
Larutan Hayem (Lampiran 3) sampai skala 101. Darah dalam pipet diaduk dengan
cara menggoyangkan pipet membentuk angka delapan selama 3-5 menit sehingga
darah tercampur rata. Dua tetes pertama larutan darah dalam pipet tersebut
dibuang, selanjutnya larutan darah tersebut diteteskan di atas haemocytometer
yang telah diletakkan gelas penutup di atasnya. Jumlah sel darah merah dapat
dihitung dengan bantuan mikroskop dengan pembesaran 400x. Perhitungan

18
dilakukan pada 5 kotak besar haemocytometer dan jumlahnya dihitung dengan
rumus (Nabib dan Pasaribu, 1989).
2.11 Penghitungan Total leukosit (Svobodova et al., 1991)
Penghitungan jumlah leukosit yaitu darah sampel dihisap dengan pipet
yang berisi bulir pengaduk warna putih sampai skala 0,5 kemudian ditambahkan
Larutan Turk’s (Lampiran 3) sampai skala 11. Darah dalam pipet diaduk dengan
cara menggoyangkan pipet membentuk angka delapan selama 3-5 menit sehingga
darah tercampur rata. Dua tetes pertama larutan darah dalam pipet tersebut
dibuang, selanjutnya larutan darah tersebut diteteskan di atas haemocytometer
yang telah diletakkan gelas penutup di atasnya. Jumlah sel darah merah dapat
dihitung dengan bantuan mikroskop dengan pembesaran 400x. Perhitungan
dilakukan pada 5 kotak besar haemocytometer dan jumlahnya dihitung dengan
rumus (Nabib dan Pasaribu, 1989) (Lampiran 4):
2.12 Larutan Hayem’s
Larutan hayem merupakan larutan yang digunakan untuk mencegah
penggumpalan darah saat akan dihitung jumlah eritrositnya. Selain itu, larutan hayem
juga berfungsi sebagai pewarna agar eritrosit dapat terlihat jelas bentuknya.
Komposisi larutan hayem menurut Anonim (2007) terdiri atas 5 gram Na2SO4, 1
gram NaCl, 0.5 gram HgCl2, dan 200 ml akuades atau larutan hayem’s terdiri dari
HgCl 25 gram, NaCl 5 gram, Na2SO4 2,5 gram dan Akuades 1000 ml.
2.13 Larutan Turks
Sampel darah diencerkan dengan larutan Turks untuk menghancurkan sel
darah merah agar jumlah sel darah putih dapat dihitung. Komposisi larutan turks
menurut Anonim (2007) terdiri atas Acetil Acid Glacial 2 ml, Gentian Violet 1
ml, dan Akuades 100 ml.

19
2.14 Haemacytometer
Haemacytometer merupakan alat yang didesain khusus untuk menghitung
sel darah tetapi haemocytometer juga dapat digunakan untuk menghitung sel tipe
lain yang berukuran mikroskopik (Anonim, 2008).
Haemacytometer ditemukan oleh Louis Charles Malassez dan terdiri atas
gelas kaca mikroskop dengan bentuk seperti empat persegi panjang dengan
lekukan yang membentuk kamar. Kamar diukir dengan menggoreskan laser yang
membentuk garis tegak lurus. Alat ini dibuat dengan sangat hati-hati oleh orang
yang ahli sehingga batas area bergaris diketahui dan kedalaman kamar diketahui.
Gambar 4. Bagian-bagian Haemocytometer
(Anonim, 2008)
Haemocytometer Improved Neubaeur (Counting Chamber) berupa
lempeng kokoh yang dirancang untuk mendapatkan suspensi sel dalam lapisan
tipis di atas guratan yang digoreskan pada lempeng. Guratan-guratan terdiri dari
segiempat-segiempat dan bujur sangkar yag besar yang tersusun dalam baris dan
kolom. Satu kelompok yang terdiri dari 25 bujur sangkar di pusatnya dipisahkan
lebih jauh menjadi 16 bujur sangkar kecil. Bagian tengah lempeng lebih rendah
daripada serambi di bagian luar. Jalur yang mirip dengan parit dalam memisahkan
bagian tengah dari bagian luar serambi pada setiap sisi. Lapisan penutupnya tebal
sehingga tahan bengkok. Hal ini memungkinkan adanya lapisan tipis suspensi sel
dengan ketebalan yang diketahui dan seragam, yang terletak di atas segiempat-
segiempat dengan luas yang diketahui. Rapatan sel diperkirakan dengan
menghitung sel dalam bujur-sangkar yang khas. Jenis pengaturan dalam guratan

20
tidak akan mempengaruhi penentuan. Yang penting adalah penggunaan yang
benar dari lempeng-lempeng penghitung (Michael, 1994).
Gambar 5. Haemocytometer Improved Neubaeur
Gambar 6. Counting Chamber
Untuk menghitung jumlah eritrosit maupun leukosit, maka jumlah bujur
sangkar dalam Bilik hitung hemocytometer type Double Improved Neubeur perlu
diketahui:
a. Ukuran seluruh bilik hitung adalah 3x3 mm (9 mm persegi yang terbagi
menjadi 9 bujur sangkar (masing-masing bersisi 1 mm).
b. Bujur sangkar terbagi lagi monjadi 9 kotak kecil.
c. 4 kotak kecil yang terletak dj. bagian pojok (ditandai huruf. W) masing-masing
terbagi lagi menjadi 16 kotak, (dengan sisi ¼ mm)sedangkan kotak kecil yang
terletak di tengah terbagi menjadi 25 bujur sangkar dengan sisi 1/5 mm
(disebut kotak R) dari kotak R tersebut masing-masing terbagi lagi menjadi 16
kotak dengan sisi 1/20 mm (tampak lebih rapat dari kotak W).
d. Leukosit dihitung di dalam bujur sangkar bersisi ¼ mm (kotak W)

21
e. Eritrosit dihitung dari dalam bujur sangkar dengan sisi 1/20 mm (kotak R)
Jarak antara bilik hitung dengan gelas penutup: 1/10 mm sehingga volume
bujur sangkar adalah sebagai berikut:

22
BAB III
METODOLOGI PRAKTIKUM
3.1 Waktu dan Tempat
Waktu : Praktikum I (Sel Darah Merah) : Senin, 26 November 2012. Pukul
10.00 s/d 12.00 WIB.
Praktikum II (Sel Darah Putih) : Senin, 3 November 2012. Pukul
10.00 s/d 12.00 WIB.
Tempat : Ruang Laboratorium Fisiologi Hewan Air, Lantai 1, Gedung
Dekanat FPIK, UNPAD
3.2 Alat dan Bahan Praktikum I
3.2.1 Alat Praktikum I
Alat – alat yang digunakan dalam praktikum Perhitungan Sel Darah Merah Pada
Ikan Lele (Clarias sp.) adalah sebagai berikut :
1. Haemacytometer, terdiri dari:
kamar hitung tipe “improved Neubauer”
Pipet Thomma
2. Mikroskop
3. Hand counter
4. Pipet tetes
5. Cover glass
6. Pisau bedah
7. Talenan
3.2.2 Bahan Praktikum I
Bahan yang digunakan dalam praktikum Perhitungan Sel Darah Merah Pada Ikan
Lele (Clarias sp.) adalah sebagai berikut :
1. Ikan Lele

23
2. Larutan Hayem’s
3. Alkohol 70%
4. Tissue
5. Aquabidest
3.3 Prosedur Kerja Praktikum I
Dalam percobaan ini langkah-langkah dalam praktikum Perhitungan Sel Darah
Merah Pada Ikan Lele (Clarias sp.) adalah sebagai berikut :
1) Menyiapkan mikroskop dengan perbesaran tertentu (40x) , lalu meletakkan
haemacytometer tipe “Improved Neubauer” di bawah mikroskop, dan
mengamatinya sampai terlihat kotak-kotak kecil baik untuk tempat
pernghitungan sel darah merah (SDM).
2) Menempatkan ikan lele pada wadah lalu melukai bagian pangkal ekornya
dengan pisau bedah.
3) Menghisap darah yang keluar menggunakan pipet Thomma sebatas skala 0,5
dan menghentikan penghisapan dengan menekan ujung lidah ke ujung karet
penghisap, kemudian menambahkan larutan Hayem’s sampai skala 101.
4) Melepaskan karet penghisap dari pipet dan kedua ujung pipet ditekan dengan
ibu jari agar cairan tidak keluar, selanjutnya digerakkan dengan arah memutar
selama 3 menit agar merata.
5) Menetesi kamar hitung dengan cairan darah tadi melalui parit
haemacytometer, kemudian dilakukan penghitungan dengan menggunakan
hand counter.
6) Untuk menghitung sel darah merah dilakukan dengan menghitung ke lima
kotak di bagian sudut dan hitung parsel kotak kemudian dijumlahkan dan
dibagi lima untuk rata-ratanya. Faktor pengali 200 x 10 x 25 = 50.000 yang
harus dikalikan dengan jumlah rata-rata sel darah merah tersebut yang
merupakan jumlah SDM per ml darah.

24
3.4 Alat dan Bahan Praktikum I
3.4.1 Alat Praktikum II
Alat – alat yang digunakan dalam praktikum Perhitungan Sel Putih Merah Pada
Ikan Lele (Clarias sp.) adalah sebagai berikut :
1. Haemacytometer, terdiri dari:
kamar hitung tipe “improved Neubauer”
Pipet Thomma
2. Mikroskop
3. Hand counter
4. Pipet tetes
5. Cover glass
6. Pisau bedah
7. Talenan
3.4.2 Bahan Praktikum II
Bahan yang digunakan dalam praktikum Perhitungan Sel Darah Putih Pada Ikan
Lele (Clarias sp.) adalah sebagai berikut :
1. Ikan Lele
2. Larutan Turks
3. Alkohol 70%
4. Tissue
5. Aquabidest
3.4.3 Prosedur Kerja Praktikum II
Dalam percobaan ini langkah-langkah dalam praktikum Perhitungan Sel Darah
Putih Pada Ikan Lele (Clarias sp.) adalah sebagai berikut :
1) Menyiapkan mikroskop dengan perbesaran tertentu (40x) , lalu meletakkan
haemacytometer tipe “Improved Neubauer” di bawah mikroskop, dan
mengamatinya sampai terlihat kotak-kotak kecil baik untuk tempat
pernghitungan sel darah merah SDM maupun SDP.

25
2) Menempatkan ikan lele pada wadah lalu melukai bagian pangkal ekornya
dengan pisau bedah.
3) Menghisap darah yang keluar menggunakan pipet Thomma sebatas skala 0,5
dan menghentikan penghisapan dengan menekan ujung lidah ke ujung karet
penghisap, kemudian menambahkan larutan Turks sampai skala 11.
4) Melepaskan karet penghisap dari pipet dan kedua ujung pipet ditekan dengan
ibu jari agar cairan tidak keluar, selanjutnya digerakkan dengan arah memutar
selama 3 menit agar merata.
5) Menetesi kamar hitung dengan cairan darah tadi melalui parit
haemacytometer, kemudian dilakukan penghitungan dengan menggunakan
hand counter.
6) Untuk menghitung sel darah putih dilakukan dengan menghitung ke empat
kotak di bagian sudut dan hitung parsel kotak kemudian dijumlahkan dan
dibagi empat untuk rata-ratanya. Faktor pengali 20 x 16 x 10 = 3200 yang
harus dikalikan dengan jumlah rata-rata sel darah putih tersebut yang
merupakan jumlah SDP per ml darah.

26
BAB IV.
HASIL DAN PEMBAHASAN
4.1 Hasil Praktikum I
Berdasarkan pengamatan yang telah dilakukan pada Praktikum I yaitu,
Perhitungan Sel Darah Merah Pada Ikan Lele (Clarias sp.) selama pengamatan
didapatkan hasil sebagai berikut :
Tabel 1. Hasil Pengamatan Kelompok 8 Perhitungan Sel Darah Merah Pada
Ikan Lele (Clarias sp.).
Jumlah Sel Darah
Merah pada Kotak TotalRata
- rata
Pengencer
an dengan
Larutan
Hayem’s
Luas
Kotak
Hitung
Ketebalan
Haemasito
meter
(mm)
Jmlah Sel
Darah
Merah
(Sel/mm3)
1 2 3 4 5
70 78 78 68 85 379 75,8 200 25 10 3.790.000
Tabel 2. Data Kelas Hasil Perhitungan Sel Darah Merah Pada
Ikan Lele (Clarias sp.) Pada Laboratorium 1.
KelompokPerhitungan Sel Darah Merah Rata-
Rata
Jumlah SDM per ml
darah (Sel/mm3)SDM1 SDM2 SDM3 SDM4 SDM5
1 104 103 93 99 88 97,4 97,4 x 50.000 = 4.870.000
2 40 40 50 50 50 46 46 x 50.000 = 2.300.000
3 98 105 95 92 110 100 100 x 50.000 = 5.000.000
4 80 89 94 91 99 90,6 90,6 x 50.000 = 4.530.000
5 82 82 73 79 76 78,4 78,4 x 50.000 = 3.920.000
6 79 70 90 115 117 94,2 94,2 x 50.000 = 4.710.000
7 80 81 71 72 71 75 75 x 50.000 = 3.750.000
8 70 78 78 68 85 75,8 75,8 x 50.000 = 3.790.000
9 103 102 82 115 85 97,4 97,4 x 50.000 = 4.870.000

27
Tabel 3. Data Kelas Hasil Perhitungan Sel Darah Merah Pada
Ikan Lele (Clarias sp.) Pada Laboratorium 2.
KelompokPerhitungan Sel Darah Merah Rata-
Rata
Jumlah SDM per ml
darah (Sel/mm3)SDM1 SDM2 SDM3 SDM4 SDM5
10 51 63 64 64 93 67 67 x 50.000 = 3.350.000
11 60 62 77 75 100 76,8 76,8 x 50.000 = 3.840.000
12 149 74 87 103 117 106 106 x 50.000 = 5.300.000
13 160 79 105 106 108 121,6 121,6 x 50.000 = 6.080.000
14 62 49 43 55 53 52,4 52,4 x 50.000 = 2.620.000
15 79 109 142 107 102 107,8 107,8 x 50.000 = 5.390.000
16 83 85 77 87 110 88,4 88,4 x 50.000 = 4.420.000
17 68 59 61 68 87 68,5 68,5 x 50.000 = 3.430.000
18 64 94 61 50 78 69,4 69,4 x 50.000 = 3.470.000
Tabel 4. Data Kelas Hasil Perhitungan Sel Darah Merah Pada
Ikan Lele (Clarias sp.) Pada Laboratorium 3.
KelompokPerhitungan Sel Darah Merah Rata-
Rata
Jumlah SDM per ml
darah (Sel/mm3)SDM1 SDM2 SDM3 SDM4 SDM5
19 41 58 72 75 53 59,8 59,8 x 50.000 = 2.990.000
20 78 76 48 65 72 63,8 63,8 x 50.000 = 3.190.000
21 80 50 86 86 68 74 74 x 50.000 = 3.700.000
22 41 58 72 75 53 59,8 59,8 x 50.000 = 2.990.000
23 57 77 70 72 73 69,8 69,8 x 50.000 = 3.490.000
24 80 50 86 86 68 74 74 x 50.000 = 3.700.000
25 80 50 86 86 68 74 74 x 50.000 = 3.700.000
26 80 50 86 86 68 74 74 x 50.000 = 3.700.000
4.2 Pembahasan Praktikum I
Pada praktikum mengenai Perhitungan Sel Darah Merah Pada
Ikan Lele (Clarias sp.) pembahasannya adalah Jumlah sel darah merah adalah
Jumlah Rata-rata Sel Darah Merah dikalikan dengan Faktor Pengali yang terdiri
dari:

28
Pengenceran dengan larutan Hayem’s
Luas kotak hitung
Ketebalan Haemacytometer
Rata-rata Sel Darah Merah hasil pengamatan adalah sebagai berikut:
Gambar 7. Kotak untuk menghitung sel darah merah.
Keterangan : K = sel darah merah
SDM 1 : 70
SDM 2 : 78
SDM 3 : 78
SDM 4 : 68
SDM 5 : 85
Rata-rata SDM : (70 + 78 + 78 + 68 + 85) / 5 = 379 / 5 = 75,8
Sedangkan Faktor Pengali digunakan adalah:
Pengenceran dengan larutan Hayem’s : 200 kali
Luas kotak hitung : 25 kali
Ketebalan Haemacytometer : 10 kali
Faktor Pengali : 202 X 25 X 10 = 50.500
Sehingga jumlah Sel Darah Merah adalah:
Rata-rata SDM X Faktor Pengali = 75,8 X 50.500
= 3.790.000 sel/mm3
Hasil penghitungan jumlah sel darah merah yang didapat dari sampel
darah ikan lele yang diuji adalah 3.790.000 sel/mm3. . Jumlah eritrosit ikan lele

29
(Clarias ssp) adalah 3,18 x 106
sel/ml (Angka et al., 1985). Jumlah eritrosit pada ikan
teleostei berkisar antara (1,05 - 3,0) x 106
sel/mm3
(Irianto 2005). Eritrosit berwarna
kekuningan, berbentuk lonjong, kecil, dengan ukuran berkisar antara 7 - 36 μm
(Lagler et al. 1977). Eritrosit yang sudah matang berbentuk oval sampai bundar, inti
berukuran kecil dengan sitoplasma besar. Ukuran eritrosit ikan lele (Clarias ssp)
berkisar antara (10 x 11 μm) – (12 x 13 μm), dengan diameter inti berkisar antara 4 –
5 μm. Pengujian ini menunjukkan bahwa jumlah sel darah merah pada ikan lele
yang diuji berada pada kisaran normal.
4.3 Hasil Praktikum II
Berdasarkan pengamatan yang telah dilakukan pada Praktikum I yaitu,
Perhitungan Sel Darah Putih Pada Ikan Lele (Clarias sp.) selama pengamatan
didapatkan hasil sebagai berikut :
Tabel 5. Hasil Pengamatan Kelompok 8 Perhitungan Sel Darah Putih Pada
Ikan Lele (Clarias sp.).
Jumlah Sel Darah Putih
pada Kotak TotalRata-
rata
Pengenceran
dengan
Larutan
Hayem’s
Luas
Kotak
Hitung
Ketebalan
Haemasitometer
(mm)
Jmlah Sel
Darah
Merah
(Sel/mm3)
1 2 3 4
158 255 208 202 823 205,75 20 16 10 658.400
Tabel 6. Data Kelas Hasil Perhitungan Sel Darah Putih Pada
Ikan Lele (Clarias sp.) Pada Laboratorium 1.
KelompokPerhitungan Sel Darah Putih Rata-
rata
Jumlah SDP per ml
darah (Sel/mm3)SDP1 SDP2 SDP3 SDP4
1 233 158 204 154 187,25 187,23 x 3200 = 599.200
2 178 204 217 222 205,25 205,25 x 3200 = 656.800
3 175 197 211 206 197,25 197,25 x 3200 = 631.200

30
4 184 130 149 166 157,25 157,25 x 3200 = 503.200
5 128 157 235 250 192,5 192,5 x 3200 = 616.000
6 113 149 126 124 128 128 x 3200 = 409.600
7 131 125 128 136 130 130 x 3200 = 416.000
8 158 255 208 202 205,75 205,75 x 3200 = 658.400
9 299 199 233 284 253,75 253,75 x 3200 = 812.000
Tabel 7. Data Kelas Hasil Perhitungan Sel Darah Putih Pada
Ikan Lele (Clarias sp.) Pada Laboratorium 2.
KelompokPerhitungan Sel Darah Putih Rata-
Rata
Jumlah SDP per ml darah
(Sel/mm³)SDP1 SDP2 SDP3 SDP4
10 412 434 451 417 428,5 428,5 x 3.200 = 1.371.200
11 317 388 426 381 365,5 365,5 x 3.200 = 1.169.600
12 225 279 244 321 267,25 267,25 x 3.200 = 855.200
13 339 373 385 452 387,25 387,25 x 3.200 = 1.239.200
14 321 314 316 292 310,75 310,75 x 3.200 = 994.000
15 317 318 322 333 322,5 322,5 x 3.200 = 1.032.000
16 237 258 247 314 264 264 x 3.200 = 844.800
17 431 402 415 403 412,75 412,75 x 3.200 = 1.320.000
18 399 453 461 433 436,5 436,5 x 3.200 = 1.396.800
Tabel 8. Data Kelas Hasil Perhitungan Sel Darah Putih Pada
Ikan Lele (Clarias sp.) Pada Laboratorium 3.
KelompokPerhitungan Sel Darah Putih Rata-
Rata
Jumlah SDP per ml darah
(Sel/mm³)SDP1 SDP2 SDP3 SDP4
19 385 368 397 375 381,25 381,25 x 3.200 = 1.220.000
20 387 365 392 369 378, 25 378,25 x 3200 = 1.210.400
21 394 487 350 364 398,75 398,75 x 3.200 = 1.276.000
22 383 373 395 380 382,75 382,75 x 3.200 = 1.224.800

31
23 366 533 564 430 473,25 473,25 x 3.200 = 1.514.400
24 284 325 307 326 310,5 310,5 x 3.200 = 993.600
25 390 377 381 388 384 384 x 3.200 = 1.288.800
26 303 390 302 362 339,35 339,35 x 3.200 = 1.085.600
4.4 Pembahasan Praktikum II
Pada praktikum mengenai Perhitungan Sel Darah Putih Pada
Ikan Lele (Clarias sp.) pembahasannya adalah Jumlah sel darah putih adalah
Jumlah rata-rata Sel Darah Putih dikalikan dengan Faktor Pengali yang terdiri
dari:
Pengenceran dengan larutan turk
Luas kotak hitung
Ketebalan Haemacytometer
Rata-rata Sel Darah Putih hasil pengamatan kelompok kami adalah
sebagai berikut:
Gambar 8. Kotak untuk menghitung sel darah putih.
SDP 1 : 158
SDP 2 : 255
SDP 3 : 208
SDP 4 : 202
Rata-rata SDP : (158+255+208+202)/4 = 205,75
Sedangkan Faktor Pengali yang kami gunakan adalah:
Pengenceran dengan larutan turk: 20 kali

32
Luas kotak hitung : 16 kali
Ketebalan Haemacytometer : 10 kali
Faktor Pengenceran : 20 X 16 X 10 = 3200
Sehingga jumlah Sel Darah Putih pada Ikan Lele hasil pengamatan
kelompok kami adalah:
rata-rata SDP X Faktor Pengenceran = 205,75 X 3200
= 658.400 Sel/mm3
Leukosit tidak berwarna dan jumlah leukosit total ikan teleostei berkisar
antara 20.000-150.000 butir tiap mm3
. Leukosit berbentuk lonjong sampai bulat
(Moyle dan Chech 1988). Pada ikan lele, mas, dan nila, leukosit jenis eosinofil dan
basofil jarang ditemukan, kecuali bila ada reaksi kekebalan dengan perantaraan sel
(Nabib dan pasaribu 1989). Ukuran rata – rata limfosit berkisar antara 4,5 - 12 μm
(Moyle dan Chech 1988). Persentase normal limfosit pada ikan teleostei berkisar
antara 71,12 – 82,88% (Affandi dan Tang 2002). Jumlah limfosit di dalam darah ikan
lebih banyak dibandingkan dengan limfosit pada mamalia. Kepadatan limfosit pada
ikan sebesar 48 x 103
sel/mm3,
sedangkan pada mamalia sekitar 2 x 103
sel/mm3
(Roberts 1978).
Menurut kami perolehan hasil perhitungan pada kelopmpok kami dengan
kelompok lain jika dibandingkan, tidak sedikit yang mendapat hasil yang jauh
berbeda dari hasil kelompok kami. Leukosit tidak berwarna dan jumlah leukosit
total ikan teleostei berkisar antara 20.000-150.000 butir tiap mm3
. Dari hasil
pengamatan, kelompok kami memperoleh jumlah sel darah putih / leukosit adalah
658.400 Sel/mm3
. Hal ini menunjukkan bahwa jumlah leukositnya berada pada
keadaan tidak normal karena melampaui jumlah normal leukosit ikan teleostei
atau ikan lele.
Beberapa faktor yang mempengaruhi ketidaknormalan jumlah leukosit
tersebut adalah menurut Moyle dan Chech (1988), leukosit berfungsi sebagai sistem
pertahanan tubuh yang akan dikirim secara khusus ke daerah yang terinfeksi dan
mengalami peradangan yang serius. Arry (2007) melaporkan bahwa peningkatan
jumlah leukosit total terjadi akibat adanya respon dari tubuh ikan terhadap kondisi
lingkungan pemeliharaan yang buruk, faktor stres dan infeksi penyakit. Sedangkan

33
penurunan jumlah leukosit total disebabkan karena adanya gangguan pada fungsi
organ ginjal dan limpa dalam memproduksi leukosit yang disebabkan oleh infeksi
penyakit. Menurut Irianto (2005), salah satu contoh penyakit pada ikan yang
menyebabkan gangguan pada ginjal dan limpa antara lain Aeromonas hydrophila,

34
BAB V.
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Setelah melakukan praktikum ini terdapat beberapa kesimpulan yang dapat
diambil, diantaranya :
Untuk mengetahui kondisi kesehatan ikan kita dapat mengetahuinya dengan
menguji sampel darah. Hal ini berdasarkan hasil penelitian bahwa darah
merupakan salah satu parameter yang dapat digunakan untuk melihat kelainan
yang terjadi pada ikan, baik yang terjadi karena penyakit ataupun karena
keadaan lingkungan.
Ciri-ciri ikan yang terserang penyakit jika dilihat dari hasil uji darahnya
adalah adanya perubahan pada nilai hematokrit, kadar hemoglobin, jumlah sel
darah merah dan jumlah sel darah putih.
Alat untuk menghitung jumlah sel darah merah adalah Haemacytometer yang
terdiri dari kamar hitung tipe “improved Neubauer” dan pipet Thomma.
Larutan yang digunakan untuk penghitungan sel darah merah adalah larutan
Hayem’s.
Untuk menghitung jumlah sel darah merah per millimeter kubik yaitu dengan
cara mengalikan jumlah rata-rata sel darah merah dari kamar hitung yang
digunakan dengan faktor pengali. Faktor pengali terdiri dari faktor
pengenceran, jumlah kotak hitung dan ketebalan Haemacytometer.
Jumlah sel darah merah dari ikan lele yang kami uji sampel darahnya adalah
2.090.000 sel/mm3. Nilai tersebut berada pada kisaran normal karena
berdasarkan litelatur jumlah sel darah merah pada ikan lele adalah 3,18 x 106
sel/ mm3.
Persentase normal limfosit pada ikan teleostei berkisar antara 71,12 – 82,88%
(Affandi dan Tang 2002). Jumlah limfosit di dalam darah ikan lebih banyak
dibandingkan dengan limfosit pada mamalia. Kepadatan limfosit pada ikan

35
sebesar 48 x 103
sel/mm3,
sedangkan pada mamalia sekitar 2 x 103
sel/mm3
(Roberts 1978).
5.2 Saran
Praktikum ini memberi pelajaran bagi kita untuk bisa mengetahui kondisi
ikan dengan cara menghitung sel darah merah pada ikan. Namun dalam praktikum
ini terdapat kesulitan dalam mengamati haemacytometer yaitu untuk menemukan
kotak hitungnya. Hal ini dikarenakan kondisi mikroskop yang kurang baik
sehingga pengamatan membuang waktu yang cukup lama.
Sebaiknya mikroskop yang akan digunakan untuk praktikum harus dalam
kondisi baik. Ketepatan menyedot darah menggunakan pipet thoma harus
diperhatikan karena jika tidak tepat pada skala yang diinginkan akan memperlama
pekerjaan. Pengenceran pun harus dilakukan sampai sampel darah merah
tercampur secara homogen dengan larutan Hayem’s dan sel darah putih dengan
larutan turks.

36
DAFTAR PUSTAKA
Abdullah Yusuf. 2008. Efektivitas Ekstrak Daun Paci – Paci Leucas Lavandulaefolia
Untuk Pencegahan dan Pengobatan Infeksi Penyakit Mas Motile Aeromonad
Septicaemia Ditunjau Dari Patologi makro Dan Hematologi Ikan Lele Dumbo
Clarias Sp. Skripsi Fakultas Perikanan Dan Ilmu Kelautan. IPB : Bogor.
Affandi R, Tang UM.2002. Fisiologi Hewan Air. Riau : Uni Press.
Amlacher E. 1970. Text Book of Fish Disease. D.A.T.F.H. Publication. New York.
USA. hlm 302.
Angka SL, GT Wongkar, Karwani. 1985. Blood Picture and Bacteria Isolated From
Ulcered and Crooked-Black Clarias Batrachus. Symposium On Pract. Measure
for Preventing and Controlling Fish Disease. BIOTROP. 17 P.
Anonim. 2007. Perhitungan Sel Darah Merah. http://www.unsjournal.com/. Diakses
tanggal 5 Desember 2012 Pukul 20.15WIB.
Anonim. 2008. Haemacytometer. http//id.wikipedia.com/haemacytometer. Diakses tanggal
5 Desember 2012 Pukul 20.17WIB.
Arry. 2007. Pengaruh Suplementasi Zat Besi (Fe) Dalam Pakan Buatan Terhadap
Kinerja Pertumbuhan dan Imunitas Ikan Kerapu Bebek Cromileptes Altivelis.
Skripsi Fakultas Perikanan Dan Ilmu Kelautan. Institut Pertanian Bogor.
Blaxhall PC. 1972. The Haemothological Assessment of The Health of Fresh Water
Fish. A Review of Selected Literature. Journal of Fish Biology 4 : 593-604.
Boyd CE. 1990. Water Quality Management For Pond Fish Culture. Elsevier Science
Publishing Company Inc, New York. Hal 146 – 159.
Chinabut S, Limsuwan C, and Kiswatat P. 1991. Histology of The Walking Catfish,
Clarias bathracus. IDRC Canada. hlm 96.
Dellman HD, Brown EM. 1992. Buku Teks Histologi Veteriner. Edisi 3. Hartono
(Penerjemah). UI Press, Jakarta.
Fujaya Y. 2004. Fisiologi Ikan : Dasar Pengembangan Teknologi Perikanan. Penerbit
Rineka Cipta, Jakarta. Hal 95-109.

37
Ganong WF. 1995. Buku Ajar fisiologi Kedokteran (Review of Medical Physiologi). Ed
ke-4. Terjemahan P Adianto. EGC, Jakarta.
Guyton AC. 1997. Buku Ajar Fisiologi Kedokteran Edisi 9. Irawati Setiawan
(Penerjemah). Penerbit Buku kedokteran EGC, Jakarta.
Hesser EF. 1960. Methods for Routine Fish Hematology. Progressive Fish Culturist.
Irianto Agus. 2005. Patologi Ikan Teleostei. Gadjah Mada University Press,
Yogyakarta.
Khairuman, K Amri. 2002. Budidaya Lele Lokal Secara Intensif. PT Agromedia
Pustaka, Tangerang.
Lagler KF, Bardach JE, RR Miller, Passino DRM. 1977. Ichthyology. John Willey and
Sons. Inc. new York-London. Hlm 506.
Maryani M. 2003. Interaksi Antara Logam Berat Kadmium(Cd) dan Infeksi Bakteri
Aeromonas Hydrophila Pada Ikan Mas Cyprinus Carpi. Skripsi Fakultas
Perikanan Dan Ilmu Kelautan, IPB.
Michael, P. (1994). Metode Ekologi untuk Penyelidikan Ladang dan Laboratorium. UI
Press, Jakarta.
Moyle PB, Cech Jr JJ. 1988. Fishes An Introduction to Icthyology. Prentice Hall, Inc.
USA. hlm 559.
Murhananto. 2002. Pembesaran Lele Dumbo di Pekarangan. PT Agromedia Pustaka,
Tangerang.
Nabib R, Pasaribu FH. 1989. Patologi Dan Penyakit Ikan. Departemen Pendidikan dan
Kebudayaan. Direktorat Jendral Pendidikan Tinggi. Pusat Antar Universitas
Bioteknologi. IPB
Primandaka JT. 1992. Pengaruh Penyuntikan Isolat Virulen Aeromonas hydrophila
Secara Intramuskular Terhadap Gambaran Darah Lele Dumbo (Clarias sp.)
Ukuran Fingerling. Skripsi. Fakultas Perikanan, IPB.
Puspowardoyo H dan Djarijah AS. 2002. Pembenihan dan Pembesaran Lele Dumbo
Hemat Air. Kanisius, Yogyakarta.
Roberts RJ. 1978. Fish Pathology. Ballier Tindall London.

38
Sastradipradja D , SHS Sikar, R Widjajakusuma, T Ungerer, A Maad, H Nasution, R
Suriawinata, R Hamzah. 1989. Penuntun Praktikum Fisiologi Veteriner.
Depdikbud, Dirjen Pendidikan Tinggi, PAU Ilmu Hayati, IPB.
Sumpeno Dedi. 2005. Pertumbuhan dan Kelangsungan Hidup Benih Ikan Lele Dumbo
(Clarias sp), Pada Penebaran 15, 20, 25, dan 30 Ekor/Liter Dalam Pendederan
Secara Indoor dengan Sistem Resirkulasi. Skripsi Fakultas Perikanan dan Ilmu
Kelautan. IPB.
Suyanto S Rachmatun. 2007. Budidaya Ikan Lele. Penebar Swadaya : Jakarta.
Svobodova, Z., Vykusova, B., 1991. Diagnostic Prevention and Therapy of Fish Diseases
and Intoxication. Reseacrh Intitute of Fish Culture and Hydrobiology Vodnany,
Czechoslovakia. Available at http://www.fao.org. [18 September 2010]
Swenson MJ. 1977. Dukes Physiology of Domestic Animal. Ed ke-9. Cornell Univ.
Press, London.
Tizard I. 1982. Veterinary Immunology, An Introduction. Ed Ke-3. W,B. Saunders
Company, Canada.
Weatherley AH. 1972. Growth and Ecology of Fish Population. Academy Press,
London. 293p.
Wedemeyer GA, Yasutke. 1977. Clinical Methods for The Assessment on The Effect of
Enviromental Stress on Fish Health. Technical Paper of The US Departement of
The Interior Fish ang the Wildlife Service, 89 : 1-17.
Wells RMG, Baldwin J, Seymour RS, Chirtian K, Britain T. 2005. Blood Cell Function
and Haematology In Two Tropical Frehswater Fishes From Australia.
Comparative Biochemistry and Physiology.
Zonneveld NE, EA Huisman, JH Boon. 1991. Prinsip - Prinsip Budidaya Ikan.
Terjemahan. PT Gramedia Pustaka Utama, Jakarta. 381 hal.

39
LAMPIRAN
Lampiran 1. Foto Alat Praktikum
Haemacytometer Pipet Thomma Mikroskop
Hand counter Pipet tetes Cover glass
Pisau bedah Talenan
Lampiran 2. Foto Bahan Praktikum
Ikan Lele Larutan Hayem’s Alkohol 70%

40
Larutan Turks Tissue Aquabidest
Lampiran 3. Foto Kegiatan Praktikum
1. Proses melukai bagian pangkal ekor
ikan lele dengan pisau bedah.
2. Proses menghisap darah yang keluar
menggunakan pipet Thomma sebatas
skala 0,5. dan menghentikan
penghisapan dengan menekan ujung
lidah ke ujung karet penghisap.
3. Proses menambahkan larutan Hayem’s
sampai skala 101.
4. Kedua ujung pipet ditekan dengan ibu
jari agar cairan tidak keluar,
selanjutnya digerakkan dengan arah
memutar selama 3 menit agar merata.

41
5. Proses pengamatan sel darah merah di
kamar hitung pada haemacytometer dan
kemudian dilakukan penghitungan
dengan menggunakan hand counter.
6. Hasil pengamatan sel darah merah di
kamar hitung pada haemacytometer di
lihat pada mikroskop dengan
perbesaran 40x.
7. Hasil pengamatan sel darah putih di
kamar hitung pada haemacytometer di
lihat pada mikroskop dengan
perbesaran 40x.
Related Documents